如何控制脂质体给药系统粒径
脂质体作为一种纳米级微粒给药体系,其在安全性、有效性、靶向性及改善难溶性药物溶解度等方面表现良好。近年来,脂质体IND及NDA相关产品申报也逐年增加。由于脂质体生产工艺复杂,质量控制一直是脂质体产业化的技术壁垒,而粒径是反应脂质体质量的一个关键质量属性,粒径控制对脂质体产品的稳定性、药代动力学、包封率等都有影响。本文将简要介绍脂质体粒径控制的方法。
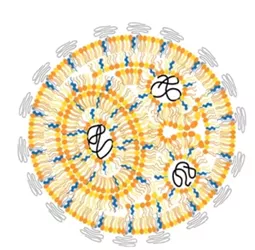
脂质体是由类似细胞膜的磷脂双分子层组成,主要是由磷脂和胆固醇组成。磷脂是膜结构的基础,胆固醇则嵌入磷脂层中间,起到稳定膜结构的作用。脂质体具有亲水亲脂性,磷脂亲水性头部聚集朝向水性界面,疏水性尾部聚集形成稳定封闭的囊泡结构。脂质体给药系统属于非均相热力学不稳定系统,脂质体在制备过程中,若粒径大小及分布不合格,则会影响产品后续质量问题。因此,粒径大小和分布是关键质量属性。目前,粒径控制常见的方法有:剪切法、均质法、超声法及薄膜挤压法。
1.剪切技术
剪切法是制剂粒径控制比较常用的方法,很多剂型粒径的控制都能用上剪切法。如吸入剂、脂肪乳等。剪切法是利用转子的高速转动,在转子和定子之间形成剧烈的涡流,物质在设备传动当中,被高速剪切力破碎,样品被细化,粒径减小。剪切的过程也是物质吸收能量的过程,由于高速运转产生的能量较大,可能会对剪切物产生一定的结构破坏。而脂质体的磷脂双分子层结构较脆弱,剪切过程中,剪切力过大产生的较大能量,容易破坏磷脂双分子层,导致脂质体质量不合格(稳定性降低,包封率降低等),故剪切法在脂质体粒径控制上并不多见。
2.均质技术
均质技术应用广泛,目前均质法常用的技术包括高压均质技术和微射流技术。均质过程总体来说也是一个能量转换使用的过程,能量转换核心是均值单元,粒径的细化也是在均值单元中完成。当样品被送到均值单元,利用液压,样品在狭窄的空间流道中高能碰撞、剪切,能量转化,产生压力差,样品细化,粒径减小[1]。均质单元在结构上可分为均质阀式及微射流容腔式。微射流容腔式是具有内部固定形状(Z型或Y型)和特定孔径的微射流交互容腔。均质阀式主要通过调节均质阀座和阀芯的贴合改变二者之间缝隙大小从而改变均质压力,达到调节粒径大小的目的,同样均质次数也可影响粒径的分布。
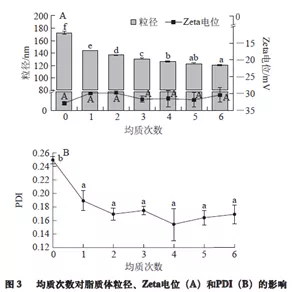
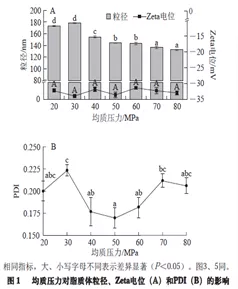
结果显示:增加均质压力和均质次数可显著降低脂质体囊泡的粒径,但均质压力和均质次数分别高于50 MPa和3 次后,脂质体囊泡粒度的降低以及其物理稳定性的提高效果不再显著,甚至当均质压力大于50 MPa时,PDI有所增大[2]。
微射流则是通过超物料形成超音速射流量来实现粒径的改善,流速越大,撞击压力越大,均质效果越好。二者不同点在于:微射流可将粒子处理到粒径分布系数(PDI)0.1以下,而均质阀式释放能量较大,动力单元活塞运动频率较高,粒子处理时间相对缩短,但均质后的粒子PDI较大或均一性较差,可根据实际需求筛选合理的粒径控制方式。Jahn 等报道水相和脂相的流速比由5:1 变为50:1时,脂质体的粒径则从140nm减小到40nm[3]。

3.超声法
超声法应用范围较小,原因是超声波法样品处理量不大,对于工业生产难满足,且超声后粒径分布往往不能达到试验预期[4]。
4.薄膜挤压法(挤出技术)
挤出技术同样广泛用于粒径控制。脂质体挤出技术的原理类似于过筛,即当脂质体温度微高于磷脂相变温度时,磷脂双分子膜结构相变,粒子柔性较好,此时通过施加一定的剪切力,对物料加压并使物料通过一定孔径大小的聚碳酸酯膜与不锈钢微孔滤板,通过圆柱形孔径后多层的脂质体混悬液被挤压成少层或单层脂质体,同时混悬液中的大颗粒以及沉淀被过滤掉,以达到控制粒径大小及分布的目的。由于滤膜孔径固定,膜孔分布均匀、孔径基本保持一致,所以粒子经过滤膜挤出后粒径大小分布较为集中,PDI较小。脂质体挤出技术涉及五个关键工艺:挤出温度、挤出压力、挤出时间、挤出次数及滤膜的选择。王昭等人在米托蒽醌脂质体的制剂学及药效研究中发现,采用薄膜挤压法可以获得平均粒径110nm的大单室脂质体,粒径均一,重现性好,且pH梯度载药的包封率可以高达97%[5]。

挤出技术常用方式[6]:
a.若溶剂与溶质纯度均较高,初步溶剂化制备的脂质混悬液杂质与大颗粒含量较低时,可以直接通过脂质体挤出器挤出。
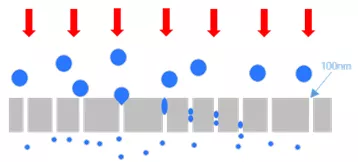
b. 先均质再挤出:对于包含大颗粒或聚团较多的脂质混悬液,最好先用超声或者高压均质机均质处理掉大颗粒或团聚较大的物料,初步处理的脂质悬液再通过脂质体挤出器进行过滤挤出,这样不容易堵塞聚碳酸酯膜,又可以获得粒径分布均匀且集中的终产物。
参考来源:
[1]LIU W,LIU J H,et al. Characterization and high-pressure microfluidization-
inducedactivation of polyphenoloxidase from Chinese Pear (Pyrus pyrifolia Nakai)[J]. JAgr Food Chem, 2009, 57(12): 5376-5380.
[2]邰克东,赵苏茂,杨紫恒,毛立科,高彦祥,袁芳.高压均质对脂质体囊泡特性和稳定性的影响[J].食品科学,2019,40(17):169-177.
[3]JAHN A,STAVIS S M, HONG J S, et al.Microfluidic mixing and the formation of nanoscale lipid vesicles [J].ACS Nano, 2010, 4(4): 2077-2087.
[4]王志国,杨经安. 脂质体粒径控制方法和设备浅析[J].医药卫生,2020(6):193-198。
[5]王昭,陈涛等.米托蒽醌脂质体的制剂学及药效研究[J].第四军医大学学报,2008,29(23):2134-2137.


 ADD:Office Suite 29A, 3/F 23 Wharf Street London ,United Kingdom,SE83GG
ADD:Office Suite 29A, 3/F 23 Wharf Street London ,United Kingdom,SE83GG  WEB:www.aquariusscientific.com
WEB:www.aquariusscientific.com EMAIL:admin@
EMAIL:admin@