不同的mRNA-LNP细胞内的蛋白表达差异(转载)
在新冠疫情爆发将近一年之际,辉瑞以及Moderna的mRNA新冠疫苗相继紧急获批上市,标志着mRNA类药物这一蛰伏了许久的颠覆性药物创新技术愈发成熟。针对多种流行性传染性疾病(包括新冠病毒)、罕见性疾病以及肿瘤等,mRNA药物可诱发体内快速生产出多种特异性的抗原/抗体,作用于相应的细胞靶点,实现较好的治疗效果。这也促进了mRNA药物相关行业的快速发展,越来越多的研究者们相继步入这一具有良好前景的领域内。
然后对于一些“新手”们,如何实现对mRNA这类特殊又娇贵的药物成分的高效体内递送,往往成为困扰他们的一大难题。目前通过参照早期已上市的siRNA类药物及mRNA新冠疫苗,大家多会采用脂质纳米粒(LNPs)来复制相应的成果,并也的确可以很好的解决问题。但是mRNA-LNP里面学问很多,LNP的大小、结构等等的不同,都可能会对相应的mRNA表达产生影响,接下来小编就带大家通过相关文章了解其中的奥秘。
首先我们关注粒径大小的影响。早期就有研究表明通过改变siRNA-LNP配方中PEG磷脂的含量,可以制备得到大小不同的siRNA-LNP。【1】参考早期的研究,研究者们通过调控PEG磷脂的含量在3 mol%~ 0.25 mol%间变化,使用微流控纳米颗粒制备系统制备得到粒径大小在45 nm至135 nm间变化的mRNA-LNP,如图1所示。
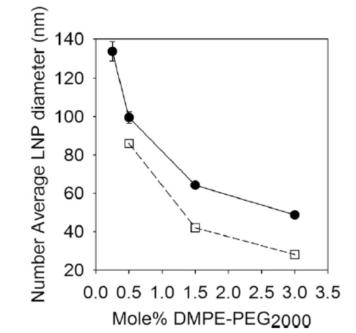
图1. 不同含量PEG磷脂下mRNA-LNP的粒径大小(实心圆为mRNA-LNP,空心体为空载的LNP)
随后分别在脂肪细胞和肝细胞上研究不同粒径大小的mRNA-LNP的体外转染效率,详见图2中数据结果所示。首先在mRNA-LNP的摄取上,肝细胞对mRNA-LNP的摄取并未展现出粒径依赖性,而在脂肪细胞上,64 nm的LNP呈现出了较突出的细胞摄取。此外发现LNP摄取几乎在瞬间开始(在第一个小时内),并且在给药后24小时脂肪细胞摄取趋于稳定,而肝细胞则更快,在8小时左右就趋于稳定了。同时也发现在两种细胞上,mRNA-LNP的细胞摄取平均都在50 %左右。
mRNA被细胞摄取后,检测其相应的蛋白表达,所采用的是编码人促红细胞生成素的mRNA。在前8个小时内,两种细胞中都没有相应蛋白的表达,而8小时后,可发现64 nm的LNP的在两种细胞中所产生的人促红细胞生成素明显高于其他粒径大小的LNP。由于LNP摄取的差异可以忽略不计,因此可以推断,蛋白表达的限制步骤是从核内体(核内体逃逸)释放mRNA,而这一过程本身严重依赖于LNP颗粒大小和细胞类型。
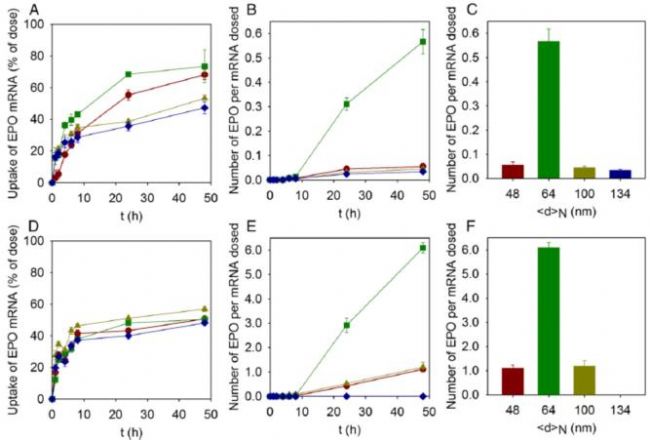
图2. 不同大小的LNPs的在脂肪细胞(A、B、C)和肝细胞上(D、E、F)的细胞摄取和蛋白表达(其中,红色、绿色、黄色、蓝色数据分别代表48、64、100、134nm的LNP)
从几种不同粒径大小的LNP的细胞摄取及蛋白表达情况来看,单纯考虑粒径大小方面的因素,粒径约在60、70 nm的mRNA-LNP相应的细胞摄取及蛋白表达效果最好。但是当然LNP的结构和组成也会起到重要的影响作用,这方面的内容我们下一次会再继续探讨。


 ADD:Office Suite 29A, 3/F 23 Wharf Street London ,United Kingdom,SE83GG
ADD:Office Suite 29A, 3/F 23 Wharf Street London ,United Kingdom,SE83GG  WEB:www.aquariusscientific.com
WEB:www.aquariusscientific.com EMAIL:admin@
EMAIL:admin@